近日,中国科学院过程工程所(IPE)与清华大学(THU)合作首次证明了二维材料氧化石墨烯(GO)能够与细胞膜形成三明治超级结构,并实现药物在膜磷脂层内的有效运输,开辟了药物精准递送新模式,为生物医药全新剂型的设计和新型纳米粒子的应用提供了方向。
纳微米粒子与细胞间相互作用对其后续生物医学应用至关重要。IPE生化工程国家重点实验室生物材料与生物剂型课题组的马光辉研究员和魏炜研究员进行了一系列研究,发现二维颗粒与传统颗粒具有截然不同的特殊生物学效应(如:在细胞膜表面通过激活力学信号实现免疫活化、在细胞内限域空间通过折叠形变诱导细胞自噬),通过合理化设计,可显著提升疫苗免疫应答效果、实现抗肿瘤智能治疗及实时诊断。相关工作相继发表于Nature Commun, 2017, 8, 14537;Biomaterials, 2012, 33, 4013; Chem Commun, 2013, 49, 3902;ACS Appl Mater Interfaces, 2015, 7, 5239;Nanoscale, 2015, 7, 19949;ACS Appl Mater Interfaces, 2017, 9, 27396。
石墨烯-生物膜超级结构虽然已有预测,但一直没有被证实。此次,IPE团队不仅利用冷冻透射等观察到GO-生物膜三明治及其形成过程,还揭示了该超级结构对细胞粗糙度、细胞流动性和细胞膜硬度的影响;更重要的是,GO可以借助该结构使更多药物进入细胞膜间,实现药物在膜磷脂双分子层的快速运动和扩散,远优于脂质体对膜特异性药物的胞内递送效果,显著增加对癌细胞的杀伤能力。上述三明治结构、膜间扩散动力学和药物递送过程,由THU团队进行了全面的计算模拟和机制解析。
相关工作发表于Science Advances 2019, June 7(eaaw3192),陈鹏宇博士(THU)和岳华副研究员(IPE)为本文第一作者,燕立唐教授(THU)和魏炜研究员(IPE)为通讯作者。该工作得到了基金委优秀青年科学基金项目以及国家重点研发计划项目的支持。
文章链接:https://advances.sciencemag.org/content/5/6/eaaw3192
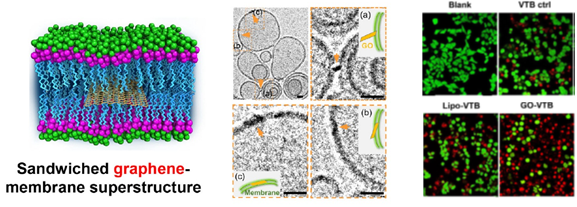
石墨烯-生物膜“三明治”超级结构及其在药物递送中的潜在应用
(左)模拟图;(中)冷冻透射照片;(右)膜间递送药物(GO-VTB)的优势结果
The sandwiched superstructure and its potent application in drug delivery
(Left): Graphic illustration; (middle) cryo-TEM experimental evidence; and (right) superior drug delivery efficacy (GO-VTB) of the sandwiched graphene-membrane superstructure.
附件下载: