近日,中国科学院过程工程所生化工程国家重点实验室马光辉研究员、夏宇飞副研究员联合微生物所严景华研究员以及北京生命科学研究院戴连攀副研究员,利用独创的颗粒化乳液技术,构建铝颗粒化乳液(PAPE),已在新型冠状病毒肺炎(COVID-19)重组疫苗对小鼠的实验中取得了显著优于商品化铝佐剂的免疫应答效果。颗粒化铝佐剂的研究强化了新冠疫苗的体液免疫和细胞免疫应答,提升了疫苗的室温储存稳定性及生物安全性,为安全、高效的新冠疫苗佐剂构建提供了新策略。
该工作于8月30日发表在《先进材料》(Advanced Materials)(DOI: https://doi.org/10.1002/adma.202004210)。
作为一种理想的新型疫苗,重组亚单位疫苗和mRNA疫苗具备简单的结构,可将病毒中表达特异性抗体的蛋白序列通过基因工程的方式,重组表达出来,无传染性且不携带引发病原体炎症或其他副作用的成分,具有良好的生物安全性。但因其免疫原性较弱,需加入安全、高效的疫苗佐剂以提升其免疫应答。为应对突发疫情,基于现有资源/原料设计的疫苗佐剂则成为一种理想的快速解决策略。目前,铝佐剂是我国唯一批准使用的疫苗佐剂,但细胞免疫效果较差,难以引发有效的细胞免疫对机体产生综合性的保护,无法满足日益增加的疫苗佐剂需求。因此,如何合理化改造铝佐剂,保证疫苗佐剂的安全及高效是亟待解决的问题。
研究人员通过颗粒化乳液将铝佐剂在油水界面排列,不仅提升了其比表面积,而且增加了疏水性,为此提升了与同样为脂类分子的细胞膜的亲和性。并且,粗糙的表面有利于树突状细胞的微管着床,进而促进了颗粒化铝佐剂乳液的细胞内吞(图b)。在进入溶酶体后,铝颗粒化乳液表面的正电性可以诱导质子海绵效应,导致大量的氢离子内流,胀裂溶酶体,实现了所递送抗原的溶酶体逃逸(图c)。在COVID-19重组疫苗的小鼠免疫实验中,与商品化铝佐剂相比,显著提升了抗原特异性抗体的血清滴度以及分泌干扰素-γ的T细胞在脾细胞中的占比(图d-e),强化了新冠疫苗的体液免疫和细胞免疫应答。与此同时,铝颗粒化乳液制备原料均为临床批准材料,在注射部位炎症、主要脏器组织切片以及血清生化指标检测中均展现良好的生物安全性。而且,柔软的铝微凝胶可以为油水界面提供更好的保护,可提升储存稳定性,具备很好的室温储存稳定性。同时,本研究采用三种不同的商品化铝佐剂制备颗粒化乳液,均得到了显著提升的细胞免疫和体液免疫效果,展示了颗粒化乳液技术在构建安全高效疫苗剂型通用性平台技术的潜力。
江南大学联合培养硕士生彭沙和东京农工大学合作培养博士生曹凤强为本文的第一作者,马光辉研究员和夏宇飞副研究员为本文通讯作者。
生化工程国家重点实验室基于多年开发的颗粒化乳液技术,经过系统研究,发现了柔性仿生疫苗递送新机制,并构建了一系列疫苗新剂型,相关工作相继发表于Nat Mater 2018, 17, 187、Advanced Materials, 2018, 30, 1801067、Advanced Materials, 2019, 31, 1801159、ACS Nano, 2019, 13, 13809等期刊上。该研究得到了国家自然科学基金创新群体项目、青年科学基金项目,中国科学院先导专项、中国科学院基础前沿科学研究计划-从0到1原始创新项目、中国科学院青年创新促进会人才项目等支持。
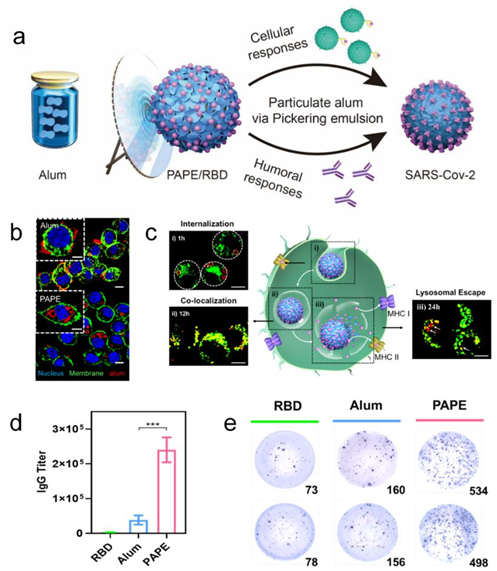
图(a)基于Pickering乳剂的颗粒化铝佐剂(PAPE);(b-e)PAPE强化COVID-19疫苗的体液免疫和细胞免疫应答;(b)促进细胞内吞;(c)诱导溶酶体逃逸;(d)血清COVID-19的RBD特异性抗体IgG的滴度显著优于商品化铝佐剂;(e)大大提升了脾细胞中IFN-γT细胞的活化。
附件下载: