外泌体是细胞分泌产生的一种囊泡型天然生物颗粒,在体内具有独特的转运路径和生物学功能,以此创建的新剂型有望在体内复杂环境下实现精准递送和预期疗效,在肿瘤个体化治疗领域具有广阔的应用前景。近日,过程工程所生化工程国家重点实验室创建了嵌合外泌体,实现了淋巴结和肿瘤组织的双重靶向,以此激活了淋巴结内免疫应答并改善了肿瘤免疫微环境。上述双效协同机制,在多种动物模型上显著抑制了肿瘤进展,为肿瘤免疫治疗带来了新思路。相关工作发表于Science Translational Medicine(Macrophage-tumor chimeric exosomes accumulate in lymph node and tumor to activate the immune response and the tumor microenvironment, Sci. Transl. Med. 13, eabb6981 (2021))。
肿瘤免疫疗法可以调动机体自身的免疫细胞识别杀伤肿瘤,是极具潜力的肿瘤治疗新策略。现有的大部分肿瘤免疫治疗侧重于提升体内免疫细胞功能和数量,但通常难以克服实体肿瘤部位的免疫抑制微环境,使得瘤内浸润的免疫细胞难以有效发挥其抗肿瘤功能。
受到免疫细胞外泌体具有免疫激活作用和肿瘤细胞外泌体具有肿瘤组织归巢现象的启发,过程工程所生化工程国家重点实验室面向临床应用的实际需求,结合十余年颗粒剂型、疫苗递送和肿瘤免疫的研究经验,提出了淋巴结-肿瘤双靶向型外泌体用于双效协同肿瘤免疫治疗的新策略。
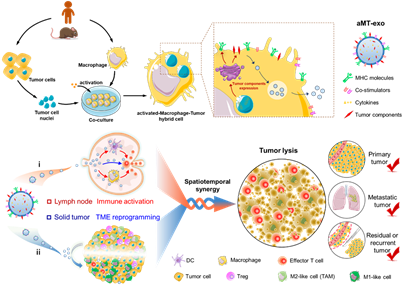
图1. 嵌合型外泌体的制备及其用于双效协同肿瘤免疫治疗的机制示意图
研究团队选择了具有强吞噬能力的巨噬细胞对肿瘤细胞核进行摄取,经过体外免疫驯化后形成免疫激活型巨噬-肿瘤杂合细胞。该细胞分泌的巨噬-肿瘤嵌合外泌体能够继承两种来源细胞的功能:一方面,借助纳米尺寸被动靶向淋巴结,依靠继承于巨噬细胞的表面抗原提呈信号和内部免疫激活因子,激活肿瘤特异性的免疫应答;另一方面,继承了肿瘤细胞的归巢能力,主动靶向到肿瘤组织,利用携带的免疫激活因子改善瘤内的免疫抑制微环境。通过上述空间双重靶向和机制双效协同的创新策略,能够最大程度保证效应T细胞在瘤内发挥免疫杀伤,显著提高免疫治疗效果。研究团队在淋巴瘤、乳腺癌、黑色素瘤多种类型的动物肿瘤模型上证明,嵌合外泌体可显著抑制原位肿瘤、转移性肿瘤及术后复发肿瘤的进展,效果远优于现有的肿瘤疫苗和T细胞回输策略。
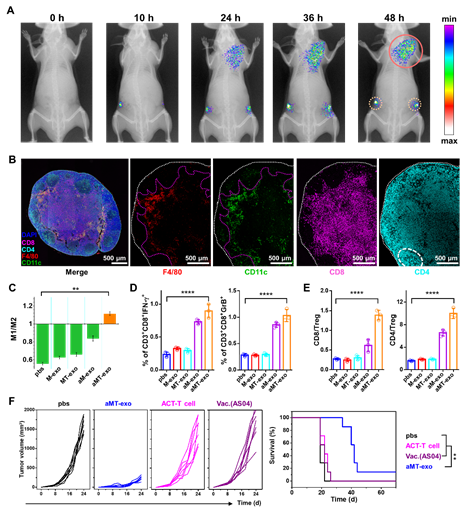
图2 嵌合外泌体的体内作用机制及在原位肿瘤模型上的疗效:(A)嵌合外泌体淋巴结-肿瘤双靶向的活体荧光成像;(B)嵌合外泌体激活淋巴结内免疫应答的免疫荧光切片;(C-E)嵌合外泌体在肿瘤内改善免疫抑制微环境;(F)不同治疗后小鼠原位肿瘤的生长曲线及生存期曲线
据研究人员介绍,上述成果仍属于临床前研究,实际临床疗效仍有待进一步验证。鉴于制备嵌合外泌体的材料均为患者自身细胞,该制剂在临床肿瘤个体化治疗领域具有较好的转化前景。目前已经通过医院伦理批准完成了临床前研究,并正在与医院合作申请个体化临床治疗研究。
过程工程所生化工程国家重点实验室马光辉研究员和魏炜研究员发现和创制了一系列药物和疫苗递送新剂型,在动物模型上成功用于肿瘤、传染病、炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。相关工作相继发表于Nat Mater 2018, 17, 187、Nat Nanotech 2021, doi: 10.1038//s41565-021-00980-7、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2017, 8, 14537、Nat Commun 2019, 10, 5165等期刊上。
本工作历经六年研究,是该团队又一个具备临床转化潜力的创新剂型。生化工程国家重点实验室王双博士为该论文第一作者,马光辉研究员和魏炜研究员为共同通讯作者。该工作得到了国家自然科学基金重点项目、国家自然科学基金创新群体项目、国家自然科学基金联合基金项目、中科院战略先导科技专项、国家重点研发计划项目、生化工程国家重点实验室开放基金和中国博士后基金的支持。
附件下载: