通过交叉科学研究,提出并发展生物医学前沿新技术,是提高重大疾病治疗效果的重要手段。胶质瘤是发病率和死亡率最高的中枢神经系统肿瘤,其中胶质母细胞瘤(GBM)是最恶性的肿瘤,被称为“癌中之王”。临床上治疗GBM以外科手术为主,同时辅助放化疗,但是效果非常有限;以手术和替莫唑胺联合治疗为例,5年生存率小于5%。因此,亟需开发新型高效的GBM治疗策略。近日,过程工程所生化工程国家重点实验室与深圳市第二人民医院合作,基于工程化的细胞外囊泡(EVs)发展了“免疫调控-化学动力-乏氧激活”多级联动的治疗新策略,为GBM的治疗带来了新思路。相关工作发表在Signal Transduction and Targeted Therapy (DOI: 10.1038/s41392-022-00894-3)。
GMB治疗棘手的原因主要有三方面。首先,血脑屏障(BBB)的存在阻止了药物进入中枢神经系统,需要发展更有效的药物递送策略;其次,单一化疗药物的使用易导致耐药性的产生,需要联合新的肿瘤杀伤手段;另外,GBM具有复杂的肿瘤微环境,对其快速生长和向周围组织的浸润起到重要作用,在治疗的过程中不容忽视。
针对上述难题,过程工程所生化工程国家重点实验室基于具有定向趋化能力的巨噬细胞EVs和工程化的设计,提出了“免疫调控-化学动力-乏氧激活”多级联动的治疗新策略,并联合深圳市第二人民医院交叉合作,进行了个体化创新药物制剂的研发。
研究团队首先基于胶质瘤患者的临床样本和小鼠模型进行了免疫组化的研究,发现胶质瘤恶性程度越高,肿瘤组织中浸润的M2型巨噬细胞/M1型巨噬细胞的比例也相应更高,并且这些巨噬细胞大多来源于外周血。在此基础上,研究团队提出了以M1巨噬细胞EVs作为载体,一方面可以利用M1巨噬细胞的趋化特性在GBM部位大量蓄积,另一方面可以通过调控巨噬细胞表型实现GBM微环境的免疫调控。
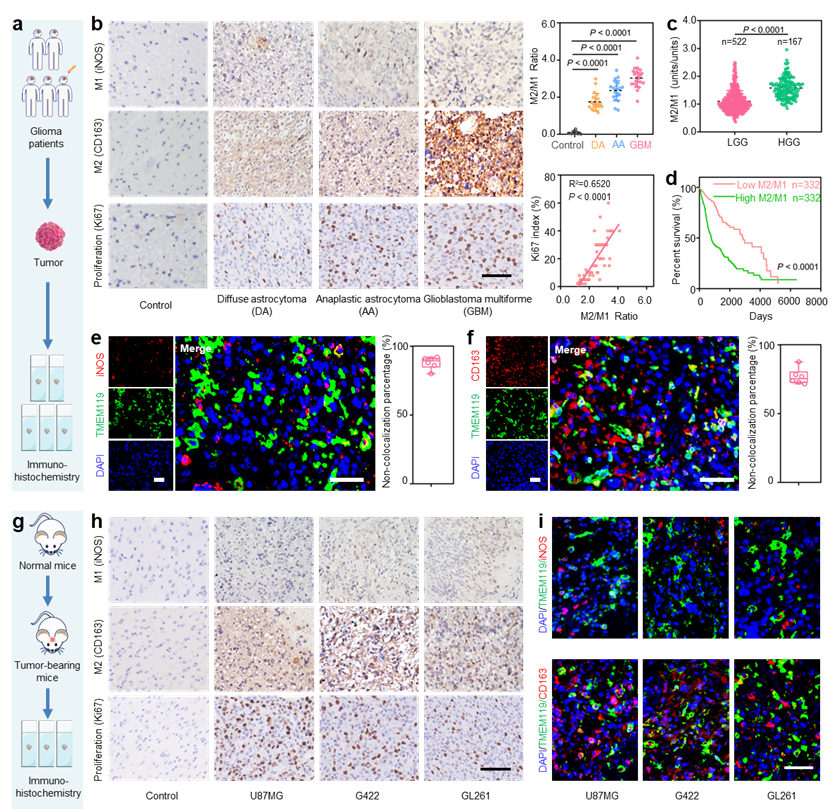
图1 胶质瘤样本中巨噬细胞的表型及其来源分析:a. 胶质瘤患者临床样本中巨噬细胞表型分析示意图;b. 不同级别胶质瘤中M1、M2和Ki67(细胞增殖指标)的分析;c. 基于TCGA数据库分析不同级别胶质瘤中M2/M1比例;d. 基于TCGA数据库分析胶质瘤患者瘤内M2/M1比例与生存曲线的关系;e. GBM组织中小胶质细胞和M1巨噬细胞的共定位分析;f. 免疫荧光染色分析GBM组织中小胶质细胞和M2巨噬细胞的共定位;g. 小鼠胶质瘤样本中巨噬细胞表型分析示意图;h. 在不同胶质瘤细胞系(U87MG、G422和GL261)中M1、M2和Ki67的分析;i. 免疫荧光染色分析不同鼠胶质瘤组织中小胶质细胞和M1或M2巨噬细胞的共定位情况;图中标尺均为50 µm
研究团队进一步在M1EVs的细胞膜和内腔差异化装载了化学激发分子对(CPPO和Ce6)以及乏氧药物(AQ4N),以此将肿瘤微环境调控、化学激发动力学及肿瘤乏氧治疗合理有序地集成于M1EVs递送系统中。上述仿生剂型(CCA-M1EVs)静脉注射后,M1EVs可以携带上述组分穿过BBB进入GBM病灶,进而实现多级联动治疗:M1EVs调控免疫微环境产生大量过氧化氢,从而激发CPPO和Ce6生成自由基(ROS),同时该反应消耗氧气激活细胞毒性药物AQ4N。借助上述作用的协同,在小鼠原位胶质瘤模型和患者来源的(PDX)模型上显著抑制了疾病的进程,大幅延长了生存期。
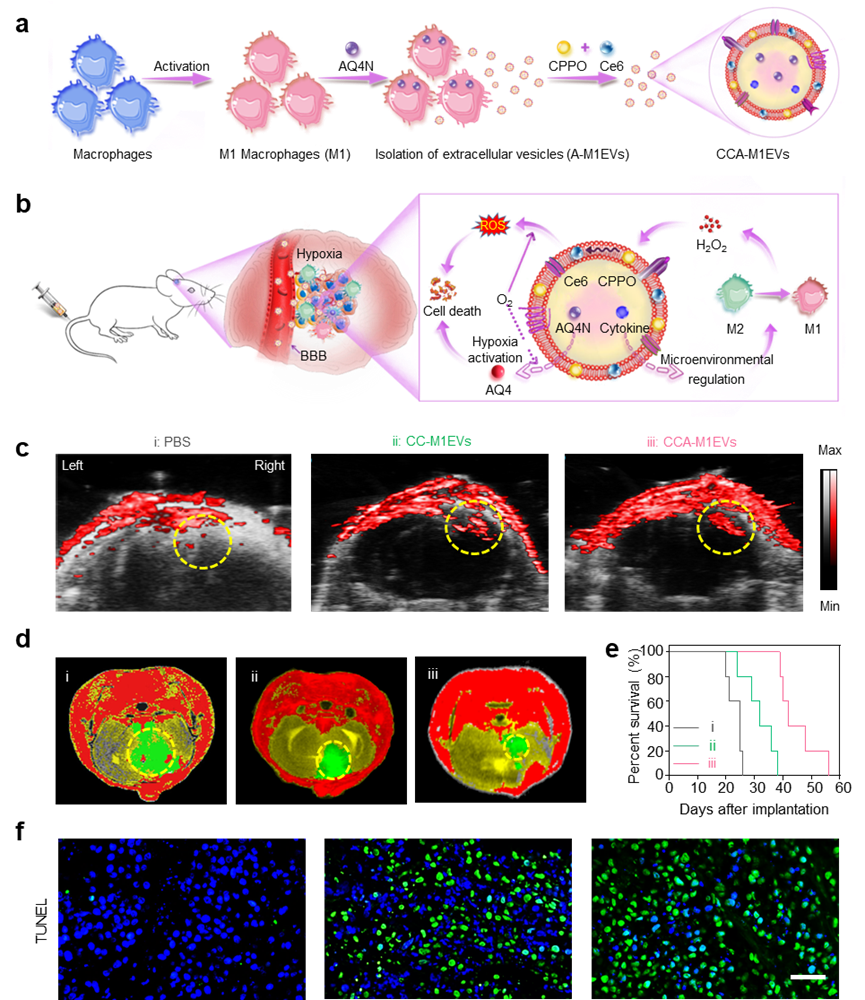
图2 基于M1EVs的仿生剂型构建方案、抗肿瘤机制及PDX疗效:a. 仿生剂型的构建示意图;b. 仿生剂型在GBM模型中的累积及免疫调节、化学激发动力学和乏氧触发化疗的协同作用示意图;c. 基于光声成像分析仿生剂型在PDX小鼠GBM病灶中的累积;d. 各组PDX小鼠的抑瘤效果(20天核磁成像);e. 各组PDX小鼠的生存期分析;f. 各组PDX小鼠的TUNEL分析(标尺50 µm)
十余年来,过程工程所生化室魏炜研究员和马光辉院士创制了一系列仿生递送新剂型,利用其体内的天然路径和属性,在动物模型上成功用于肿瘤、传染病、炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。相关工作相继发表于Nat Nanotech 2021, 16, 1413、Sci Transl Med 2021, 13, eabb6981、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2019, 10, 5165、Nat Commun 2017, 8, 14537、Adv Mater 2020, 32, 2002085、Adv Mater 2020, 32, 2002940等期刊上。
王晓君博士和丁辉博士为该论文的共同第一作者,魏炜研究员、马光辉研究员和李维平教授为共同通讯作者。该工作得到了国家自然科学基金、国家重点研发计划和深圳市神经外科学重点实验室的支持。
附件下载: