视网膜缺血再灌注(RIRI)损伤是多种视网膜疾病的共同病理机制。近日,过程工程所生物药制备与递送全国重点实验室与朝阳医院合作,基于大量眼内液临床样本,设计并创制了工程化神经干细胞外泌体(CataKNexo),在动物模型上通过病灶部位的精准靶向以及抗氧化损伤-神经保护的双效协同,为视网膜缺血再灌注损伤的治疗提供了新思路。相关工作于4月15日发表在Cell Reports Medicine(DOI:10.1016/j.xcrm.2025.102052)。
视网膜缺血再灌注损伤是视网膜静脉阻塞、糖尿病视网膜病变等视网膜缺血性疾病的典型病理生理过程,全球患病人数众多。视网膜激光光凝术等传统疗法治疗视网膜病变已有50多年,疗效有限,并可能产生视野缩窄、视神经萎缩等副作用。因此,亟需开发新型高效的RIRI治疗策略。
针对上述挑战,生物药制备与递送全国重点实验室主任魏炜,中国科学院院士、过程工程所研究员马光辉与北京朝阳医院眼科主任陶勇教授团队展开深入合作,基于临床发现,提出了工程化外泌体治疗RIRI的新策略。通过对大量RIRI患者的玻璃体液样本研究,团队发现这些样本的过氧化氢水平大幅升高且过氧化氢酶活性明显降低,二者失衡程度显著高于其他氧化应激指标,为团队提供了抗氧化应激损伤的靶标。在小鼠模型中,团队进一步验证了上述发现,并观察到视网膜外核层是氧化应激损伤最严重的区域。在此基础上,团队创新设计了聚赖氨酸(K10)修饰和过氧化氢酶表达的神经干细胞外泌体(CataKNexo)。经玻璃体腔注射后,CataKNexo能够富集到视网膜节细胞层,随后借助K10的渗透作用有效到达外核层,利用过氧化氢酶的抗氧化功能和神经干细胞外泌体的神经保护作用,实现协同治疗。
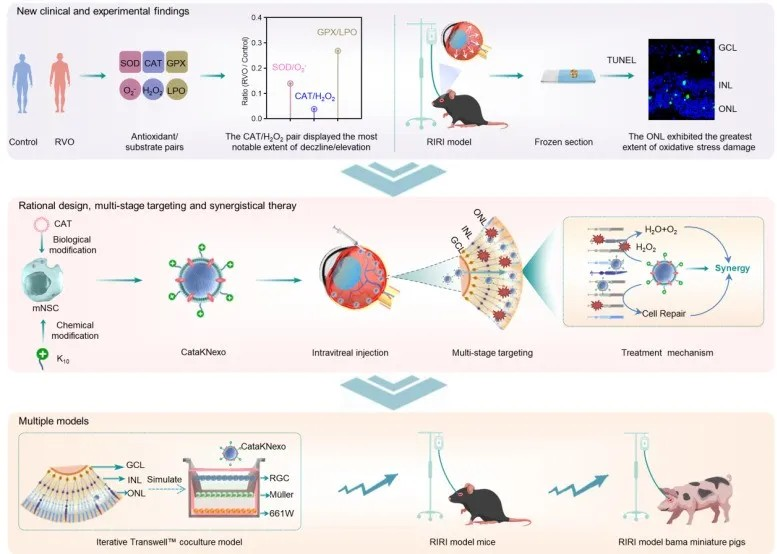
图 CataKNexo的理性设计、制备及协同治疗效应示意图
为全面验证CataKNexo的作用机制及疗效,团队构建了多种体内/外模型。在体外模拟的视网膜三层结构的Transwell模型中,CataKNexo通过K10介导的转胞吞作用到达外核层。在RIRI小鼠模型中,CataKNexo抑制了视网膜因过氧化氢引起的细胞死亡,并发挥了神经保护作用,小鼠的视网膜功能得到部分恢复。此外,团队还构建了RIRI小型猪模型,CataKNexo同样展现出令人振奋的抗氧化和视神经保护作用。
CataKNexo的研发为治疗RIRI提供了全新的思路和方法,其精准靶向和协同治疗特性在眼科领域具有重要的科学意义和临床潜力。上述成果仍处于动物水平的临床前研究阶段,实际临床疗效有待进一步研究。
近年来,过程工程所生物药制备与递送全国重点实验室主任魏炜和中国科学院院士马光辉创制了一系列仿生剂型,在动物模型上成功应用于肿瘤、传染病和炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床研究。相关工作相继发表于Nature 2023, 624, 630、Nat Nanotechnol 2023, 18, 933、Nat Nanotechnol 2021, 16, 1413、Cell Host & Microbe 2024, 32, 1502、Sci Transl Med 2021, 13, eabb6981、Nat Biomed Eng 2024, 8,1436、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Nat Commun 2023, 14, 8398、Nat Commun 2023, 14, 4505、Nat Commun 2022, 13, 4214、Nat Commun 2021, 12, 6399、Nat Commun 2019, 10, 5165、Nat Commun 2017, 8, 14537、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192等期刊上。
附件下载: