慢性乙肝的治愈之路充满挑战,抗病毒疗法需要长期服药,且只能达到功能性治愈。免疫疗法则能提升机体自身的免疫功能,清除受感染的细胞,是一种很有前景的治疗策略。传统的铝佐剂乙肝疫苗仅能诱导体液免疫应答,细胞免疫较弱。微球佐剂可通过多种形式携载抗原,使可溶性抗原转变为颗粒型抗原,有利于提高细胞免疫应答[1],在预防性疫苗及治疗性疫苗上均具有潜力。但应用于治疗性疫苗还需要进一步合理设计,以提升细胞杀伤功能。环磷酸鸟苷-腺苷酸合成酶(cyclic GMP - AMP synthase, cGAS)-干扰素基因刺激因子(stimulator of interferon gene, STING)信号通路是识别胞质DNA,从而调节固有免疫和适应性免疫的一条重要通路[2]。激活STING通路,可以促进Ⅰ型干扰素的分泌,提高细胞毒性T淋巴细胞(CTL)杀伤功能。但STING配体位于细胞质中,如何使用安全性的材料,设计简单的微球并与STING通路结合到一起,充分发挥作用,还有待进一步研究。
为此,中国科学院过程工程研究所生化工程国家重点实验室马光辉研究员团队提出采用课题组开发的快速膜乳化技术构建了DDAB-PLA(DP)和包埋STING刺激剂DMXAA(DP-D)的微球疫苗制剂。其中聚乳酸(PLA)为FDA批准的生物可降解材料,生物相容性好,双十八烷基二甲基溴化铵(DDAB)为处于临床研究阶段的阳离子脂,将其引入PLA微球中,使微球带正电,既可以通过静电作用吸附抗原,又可以通过质子泵效应,促进溶酶体逃逸,使DMXAA释放到胞质中,与配体结合激活下游通路,发挥协同作用。除可以在健康鼠中诱导产生高水平HBsAg特异性抗体,提高细胞免疫外,研究者进一步成功构建慢性乙肝模型鼠,在模型鼠上进行了治疗效果的评价。该研究成果发表在Journal of Controlled Release期刊2020年第321期上。
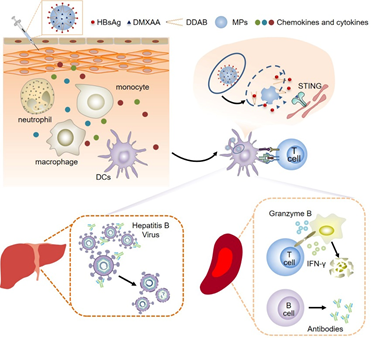
图1 微球疫苗作用机制图
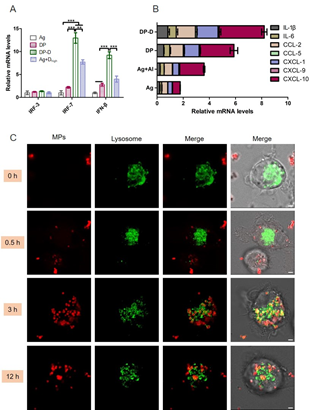
图2 A) BMDCs胞内IRF-3/7和IFN-β的mRNA表达水平,B) 注射部位细胞因子和趋化因子mRNA表达水平,C) DP微球在BMDCs中的胞内转运共聚焦图(其中红色为尼罗红标记的微球,绿色为Lysotracker Green标记的溶酶体)
在本研究中,向PLA微球中引入DDAB,使微球荷正电,进一步装载STING刺激剂DMXAA,分别构建DDAB-PLA(DP)和DDAB-PLA-DMXAA(DP-D)微球。与未添加刺激剂的DP微球相比,DP-D微球相应信号通路表达提高。微球吸附HBsAg(吸附率80%以上)后得到微球疫苗制剂。微球疫苗制剂可促进注射部位炎症因子和趋化因子的表达,招募免疫细胞,被树突状细胞(DCs)摄取后可通过质子泵效应逃逸出溶酶体,促进DMXAA释放到细胞质中,与位于胞质中的STING结合,引起下游反应。
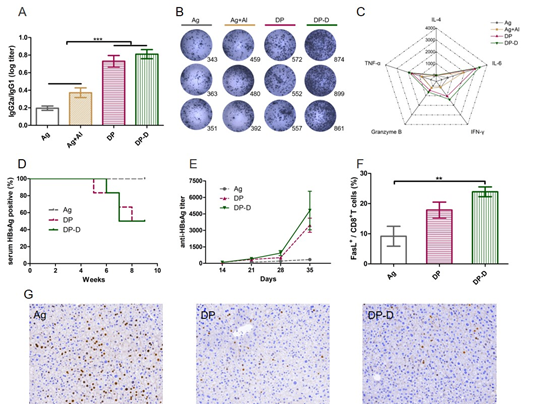
图3 动物免疫实验结果。A-C) 健康鼠结果:A) HBsAg特异性IgG2a/IgG1抗体的比值,B) 产生IFN-γ的脾细胞斑点,C) 脾细胞上清中的细胞因子雷达图;D-G) HBV模型鼠结果:D) 血清中HBsAg表达水平,E) 血清中HBsAg特异性抗体IgG,F) CD8+ T细胞的杀伤性标志FasL表达,G) 肝脏中HBcAg表达,其中蓝色为细胞核、褐色为HBcAg
研究者首先在健康鼠中进行免疫实验,微球疫苗制剂诱导高水平的抗体,尤其是IgG2a/IgG1,表明诱导Th1极化的体液免疫应答,同时提高了产生IFN-γ的脾细胞数量,促进IFN-γ、Granzyme B等细胞因子的分泌。进一步采用尾静脉注射重组乙肝腺病毒(rAAV/1.3HBV)的方式成功构建HBV慢性感染模型鼠[3],用于微球制剂的治疗性效果评价。免疫后诱导产生HBsAg特异性抗体,引起血清中HBsAg的下降。同时可以促进脾细胞活化,提高CD8+ T细胞表面FasL的表达,可介导高水平的CTL杀伤。免疫周期结束后,血清转阴率达到50%,肝脏中表达的HBcAg也降低。
本研究中构建的微球疫苗制剂提高了细胞免疫,在模型鼠上取得了较好的治疗效果,为治疗性慢性乙肝疫苗的研发提供了新思路,对慢性乙肝的治疗具有指导意义。
中国科学院过程工程研究所生化工程国家重点实验室博士生卢婷为本文第一作者,马光辉研究员为通讯作者。该工作得到了国家自然科学基金创新研究群体项目(No. 21821005)和国家重大科技专项(No. 2014ZX09102045)的支持。
【参考资料】
[1] B.K. Lee, Y. Yun, K. Park, PLA micro- and nano-particles, Adv. Drug Delivery Rev., 107 (2016) 176-191.
[2] M. Luo, H. Wang, Z.H. Wang, H.C. Cai, Z.G. Lu, Y. Li, M.J. Du, G. Huang, C.S. Wang, X. Chen, M.R. Porembka, J. Lea, A.E. Frankel, Y.X. Fu, Z.J.J. Chen, J.M. Gao, A STING-activating nanovaccine for cancer immunotherapy, Nat. Nanotechnol., 12 (2017) 648-654.
[3] D. Yang, L.C. Liu, D.M. Zhu, H. Peng, L.S. Su, Y.X. Fu, L.G. Zhang, A mouse model for HBV immunotolerance and immunotherapy, Cell. Mol. Immunol., 11 (2014) 71-78.
附件下载: