利用已批准的安全性好的简单材料,通过巧妙的设计使其发挥更高的性能,是剂型基础研究快速进入临床应用转化的重要策略。近日,中科院过程工程所生化工程国家重点实验室基于食品药品监督管理局(FDA)批准的聚乳酸简单材料开发新型肿瘤疫苗取得重要进展,其独特的“抗原后包埋”、“多样化装载”、“免疫环境协同调控”等特性极大地提高了抗原利用率及细胞免疫应答水平,显著抑制了肿瘤进展。该工作发表于Science Advances(DOI:http://doi.org/10.1126/sciadv.aay7735)
肿瘤免疫疗法在2013年被Science评为十大科学突破榜首。在众多免疫疗法中,肿瘤疫苗能够调动机体自身的免疫细胞杀伤肿瘤,极具临床应用潜力。然而单独肿瘤抗原进入体内后免疫原性非常弱,难以激发有效的免疫应答。
针对该难题,中科院过程工程所生化工程国家重点实验室生物剂型与生物材料团队马光辉研究员和魏炜研究员进行了系统研究,发现和创制了一系列疫苗递送新剂型,在动物模型上已成功用于乳腺癌、黑色素瘤、淋巴癌等恶性肿瘤的预防和治疗,并且部分剂型已通过伦理批准进入临床前和临床研究。相关工作相继发表于Nat Mater 2018, 17, 187、Nat Commun 2017, 8, 14537、Adv Sci 2017, 4, 1700083、ACS Nano 2015, 9, 4925、ACS Cent Sci 2019, 5, 796、Small 2018, 14, 1704272、Biomaterials 2013, 34, 8291等期刊上。
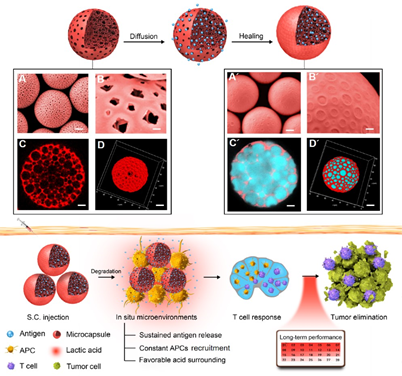
图1. 新型肿瘤疫苗剂型的制备及其免疫机制:基于独特的“后包埋”策略,高效装载肿瘤抗原(上);通过注射部位免疫微环境的协同调控,显著增强疫苗的免疫应答水平(下)
针对抗原装载方法复杂、需要多次注射免疫、体内有效利用率低、交叉提呈较弱的问题,同时确保疫苗剂型安全性和成药性,该团队提出了基于聚乳酸(FDA批准材料)自愈合大孔微球的肿瘤新策略。利用聚乳酸较低的玻璃态转化温度,可以在温和条件下将溶液中的抗原有效封装在大孔球内部,这种简单独特的“后包埋”的方法不仅保护了抗原的生物活性,并且利于医院剂型的现场配置。
同时,通过对微球尺寸和降解速率的合理设计,可以在注射部位分别实现对抗原提呈细胞募集和抗原释放的精准调控,最大化提升抗原的摄取效率。另外,聚乳酸降解后产生的乳酸分子可在注射部位产生微酸环境,以此促进Th1型细胞因子的分泌和抗原在细胞内的交叉提呈,进而强化后续的细胞免疫应答。
据研究人员介绍,大孔微球可以作为疫苗的底盘,内部适合装载多肽、蛋白、核酸等多种亲水性抗原,而骨架还可以同时负载单磷酰脂质A(MPLA)、咪喹莫特等疏水性佐剂,以满足不同疫苗剂型的需求。
基于上述优势,该肿瘤疫苗剂型在动物模型上单次注射后即可诱导高效且长期的特异性免疫应答,在乳腺癌、淋巴瘤、黑色素瘤等多种肿瘤模型和蛋白抗原、多肽抗原、新抗原上取得了优于商品化剂型(AS04)的疗效,并且展示出了非常好的安全性。该剂型目前正在与医院合作申请临床伦理,用于肿瘤新抗原的个体化免疫治疗。
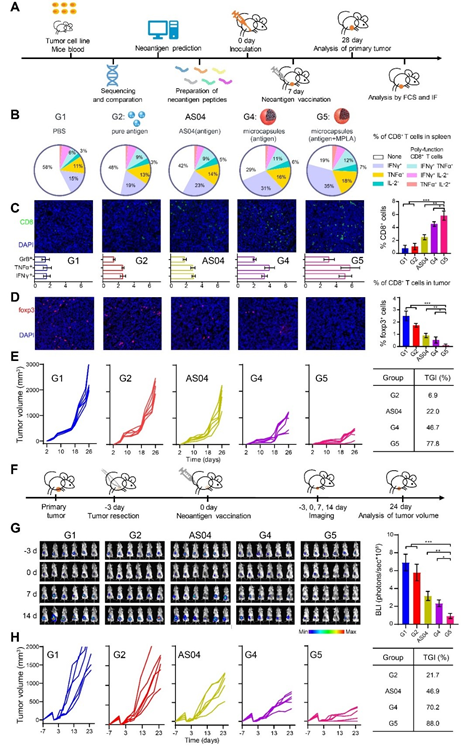
图2.自愈合大孔微球用于肿瘤新抗原的个体化免疫治疗:(A)新生抗原疫苗构建及接种策略;(B)脾多能CD8 T细胞百分比;(C)瘤内效应CD8 T细胞切片染色及亚型分析;(D)瘤内T reg细胞切片染色及统计分析;(E)抑瘤曲线及抑瘤率
中国科学院过程工程所生化工程国家重点实验室习晓博博士及叶通博士生为该论文共同第一作者,魏炜研究员及马光辉研究员为共同通讯作者。该工作得到了国家重点研发计划项目、中科院战略先导科技专项和国家自然科学基金群体项目的支持。
附件下载: