利用载体增强肿瘤部位的药物富集是提高抗肿瘤疗效的重要手段。近日,过程工程所生化工程国家重点实验室与上海交通大学医学院附属同仁医院合作,利用不同体外培养条件驯化肿瘤细胞,以此对外泌体的脂质组分进行重编程设计,筛选出具有更强归巢能力的外泌体,并进一步协同装载光敏药物与化疗药物,在多种小鼠模型上均显著抑制了肿瘤进展,为肿瘤个体化治疗带来了新思路。相关工作于3月16日发表在Advanced Science(DOI: 10.1002/advs.202002787)。
传统抗肿瘤药物载体通常基于人工合成的材料进行制备,并且需要进一步的功能化修饰(如配体偶联等)以增强肿瘤部位药物富集,但载体材料的安全性及构建的复杂性一直严重制约着抗肿瘤药物载体的应用转化,传统的研发思路亟需改变。外泌体是细胞分泌的小囊泡,直径约为30-150 nm,具有典型的脂质双分子层结构,在细胞间的物质和信息传递中具有重要作用,近年来作为天然药物载体已经得到越来越多的关注。尤其是肿瘤细胞外泌体具有一定的归巢能力,在递送抗肿瘤药物时具有天然的优势,如何进一步提高其靶向性和智能性,依然是该领域尚未解决的难题。
受到肿瘤组织特殊微环境的启发,生化工程国家重点实验室生物剂型与生物材料团队的马光辉研究员和魏炜研究员与上海交通大学医学院附属同仁医院王玉刚主任医师进行了合作,提出采用和肿瘤组织环境相似的外界条件(酸性、H2O2、乏氧等)驯化肿瘤细胞,发现酸性环境会促使肿瘤细胞分泌更多外泌体,并且可以提高这些外泌体被同源肿瘤细胞摄取的性能。通过脂质组学和分子动力学模拟发现,驯化过程会增加外泌体细胞膜成分中甘油脂的比例,进而通过其自聚集重排特性增强与同源肿瘤细胞的相互作用,提高同源靶向能力。利用上述重编程后的外泌体联合装载光敏和化疗药物,通过近红外激光照射活化外泌体中的光敏药物,使其产生大量活性氧进而破坏外泌体的结构并释放化疗药物,以此实现在肿瘤组织的响应释放和联合治疗。
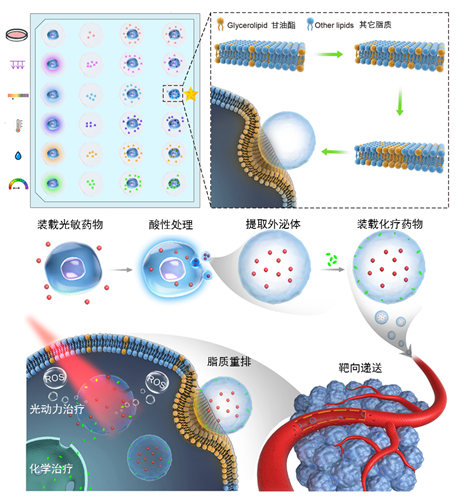
图1 基于肿瘤细胞外泌体的重编程策略和个体化联合治疗的示意图
肿瘤细胞可以从微创和手术样本中获得,并可以在体外通过特定的培养条件进行扩增,因而可以获得患者自体的外泌体,实现个体化精准抗肿瘤治疗,具有更好的临床应用前景。上述研究已在胃癌荷瘤小鼠模型和胃癌患者来源的异种移植瘤模型上确认了显著的疗效,但仍处于动物水平的临床前研究,实际临床疗效仍有待进一步确认。
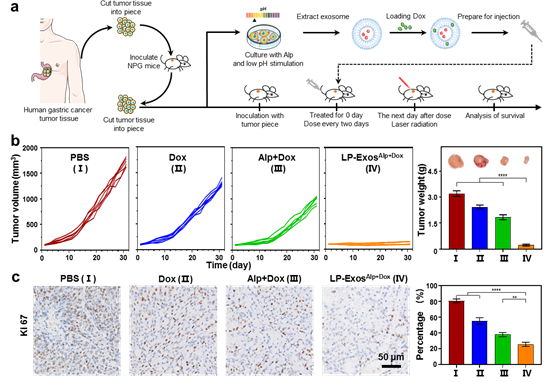
图2 基于重编程的肿瘤外泌体剂型在胃癌患者来源的异种移植瘤模型上的疗效评价:(a)模型的构建及治疗策略;(b)小鼠肿瘤生长曲线及最终瘤重;(c)肿瘤组织免疫组化分析
2006年起,过程工程所生化室马光辉研究员和魏炜研究员发现和创制了一系列抗肿瘤递送新剂型,在动物模型上已成功用于乳腺癌、黑色素瘤、淋巴癌、胃癌等恶性肿瘤的治疗,部分剂型已通过伦理批准进入临床前和临床研究。相关工作相继发表于Nat Mater 2018, 17, 187、Nat Biomed Eng 2020, s41551-020-00624-6、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2017, 8, 14537、Nat Commun 2019, 10, 5165、Adv Mater 2020, 32, 2002085、Adv Mater 2020, 32, 2002940等期刊上。
巩昌国、张潇博士和施敏主任医师为该论文共同第一作者,马光辉研究员、王玉刚主任医师和魏炜研究员为共同通讯作者。该工作得到了国家自然科学基金、国家重点研发计划、中科院战略先导科技专项和上海市卫生健康委员会重点学科项目的支持。
附件下载: