促进药物在肿瘤部位的富集和渗透是提高抗肿瘤治疗效果的重要手段。近日,过程工程所生化工程国家重点实验室与中国科学院大学化学科学学院合作,在血小板中装载光热纳米颗粒与免疫激动剂,制备新型血小板仿生剂型,通过使其在肿瘤血管部位的富集和肿瘤深部组织的渗透,实现了高效的肿瘤光热-免疫联合治疗,在多种动物模型上均显著抑制了肿瘤进展,为肿瘤的靶向递送和联合治疗带来了新思路。相关工作发表于Science Advances上(https://doi.org/10.1126/sciadv.abd7614)。
近年来,光热疗法由于治疗部位精确可控、杀伤效率高且副作用小等优点,受到越来越多的关注。研究人员目前已研发了多种载体,期望将光敏剂递送至肿瘤部位。然而,由于肿瘤的异质性和个体差异,富集效果有待提高。肿瘤组织具有致密的细胞外基质及较高的间质渗透压,进一步限制了载体在肿瘤内渗透。此外,治疗后肿瘤部位边缘残留的微小病灶,也容易造成肿瘤的转移和复发。
血小板天然粘附受损血管并能在激活状态下形成血栓和分泌纳米囊泡,受此启发,并结合十余年疫苗佐剂和肿瘤免疫的研究经验,生化工程国家重点实验室生物剂型与生物材料团队的马光辉研究员和魏炜研究员提出了血小板仿生剂型用于肿瘤光热-免疫联合治疗的新策略,并与中国科学院大学田志远教授进行了合作研究。
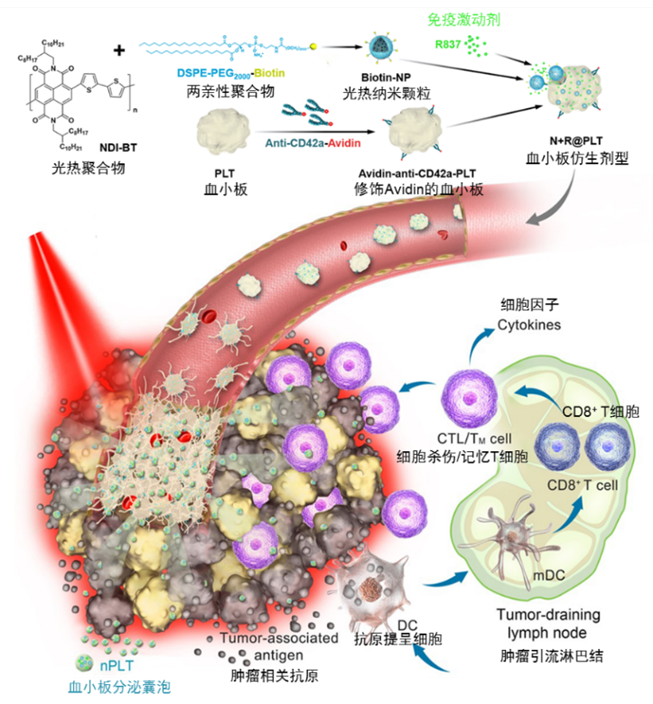
图1 基于血小板的仿生剂型在肿瘤光热-免疫联合治疗中的作用示意图
研究人员将具有高光热转换效率的聚合物纳米颗粒和免疫激动剂温和高效地导入血小板中,在体内借助血小板的天然性质,选择性地粘附于有缺陷的肿瘤血管部位。在低功率近红外光照射下,光热所引起的肿瘤局部急性血管损伤可激活粘附的血小板,通过级联效应在肿瘤血管处形成血栓,以此形成光热纳米颗粒和免疫激动剂的“弹药库”。富集的血小板在上述激活状态下还可进一步分泌纳米级血小板囊泡,将光热纳米颗粒和免疫激动剂运送到肿瘤组织深处。这样不仅有利于光热清除更多的肿瘤细胞,还可以增强肿瘤抗原的免疫原性,完全抑制肿瘤的转移和复发。
所装载的纳米颗粒、药物等具有很好的灵活性,并且血小板可从患者或者供体获得,因此,该血小板仿生剂型在肿瘤个体化精准治疗领域具有较好的临床应用前景。据研究人员介绍,上述成果已完成人源化血小板剂型的构建,并在重建人源化免疫系统的病人来源肿瘤异种移植模型上确认了显著的疗效,但仍处于动物水平的临床前研究,实际临床疗效仍有待进一步确认。
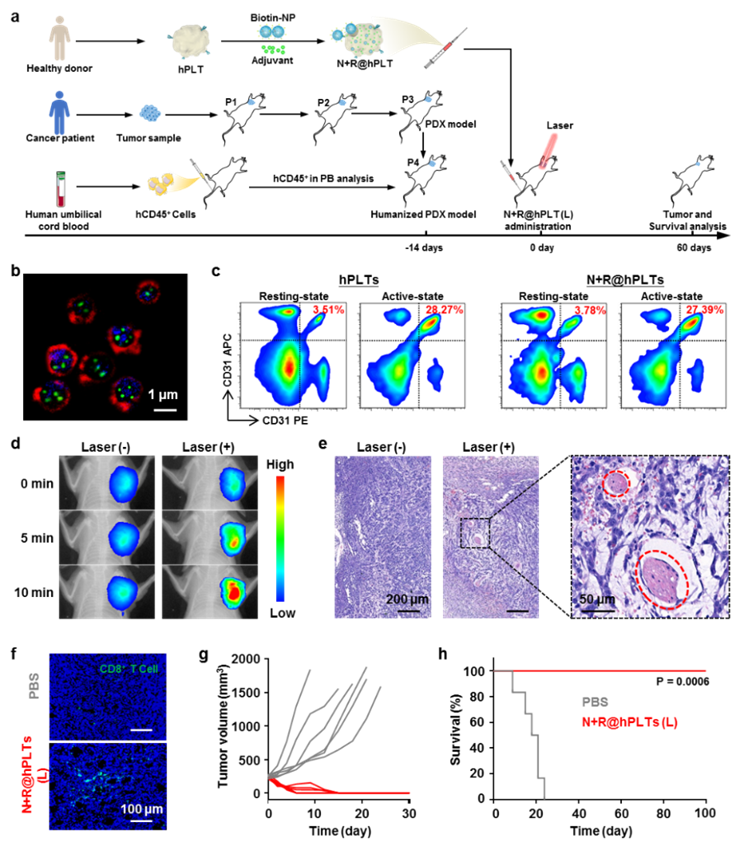
图2 基于人源血小板的仿生剂型在重建人源化免疫系统的病人来源乳腺癌异种移植模型上的疗效:(a)模型的构建及治疗策略;(b)人源血小板仿生剂型的超分辨荧光成像;(c)流式细胞术表征人源血小板仿生剂型聚集能力;(d, e)光热诱导人源血小板仿生剂型在肿瘤部位的聚集;(f)肿瘤组织冰冻切片,显示CD8+ T细胞的浸润;(g, h)小鼠肿瘤生长曲线及生存期曲线
十余年来,过程工程所生化室马光辉研究员和魏炜研究员已发现和创制了一系列抗肿瘤递送新剂型,在动物模型上成功用于乳腺癌、黑色素瘤、淋巴癌等恶性肿瘤的治疗,并且部分剂型已通过伦理批准进入临床前和临床研究。相关工作相继发表于Nat Mater 2018, 17, 187、Nat Biomed Eng 2020, s41551-020-00624-6、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2017, 8, 14537、Nat Commun 2019, 10, 5165、Adv Mater 2020, 32, 2002085、Adv Mater 2020, 32, 2002940、Adv Sci 2020, 7, 2001108等期刊上。
生化室吕岩霖博士及栗锋博士生为该论文共同第一作者,马光辉研究员、魏炜研究员和田志远教授为共同通讯作者。该工作得到了国家自然科学基金面上项目、创新群体项目、青年基金项目,国家重点研发计划项目和中科院战略先导科技专项的支持。
附件下载: