胶质母细胞瘤(GBM)预后差、复发率高、死亡率高,亟需通过学科交叉发展新理念和新技术,以增强治疗效果。近日,过程工程所生化工程国家重点实验室与深圳市第二人民医院合作,通过分析大量胶质瘤患者临床样本发现了乳酸异常代谢的规律,以此构建了具有靶向富集、代谢调控和协同治疗功能的创新仿生剂型,在患者来源的细胞模型和动物模型上均显著抑制了GBM的进展,为GBM的高效治疗提供了新思路。相关工作发表于Nature Communications (DOI: 10.1038/s41467-022-31799-y)。
乳酸代谢异常在肿瘤发生发展中发挥着重要的作用,针对乳酸代谢的抗肿瘤治疗得到了越来越多的关注。然而,该策略在GBM治疗中难以发挥有效作用:一方面,血脑屏障(BBB)的存在能够阻碍包括乳酸代谢抑制剂在内的大多数药物进入中枢神经系统,需寻求更有效的靶向递送新策略;另一方面,GBM的浸润性和复杂性使得单一的乳酸代谢治疗效果有限,需进一步联合其他治疗手段。
针对以上难题,结合仿生剂型工程的多年研究经验,生化工程国家重点实验室生物剂型与生物材料团队的魏炜研究员和马光辉院士提出了创建仿生剂型用于GBM代谢调控和靶向协同治疗的新策略,并联合深圳市第二人民医院神经外科团队交叉合作,探索出了GBM个体化治疗的新模式。
研究团队首先对胶质瘤患者的临床样本和小鼠胶质瘤模型进行了免疫组化的分析,发现胶质瘤恶性程度越高,肿瘤组织内乳酸代谢越强。据此,研究团队提出了代谢调控结合靶向协同治疗的GBM高效治疗新思路。具体而言,将血红蛋白(H)、乳酸氧化酶(L)、草酸双酯(CPPO)(P)、光敏剂Ce6(C)通过一步法制备成HLPC颗粒后,进行GBM细胞膜镀层,构建仿生M@HLPC剂型。静脉注射后,M@HLPC通过整合素和粘附蛋白间特异性识别介导的转胞吞途径跨越BBB,进一步通过膜表面CD44等分子同源靶向GBM。在此基础上,M@HLPC催化肿瘤内高表达的乳酸产生丙酮酸和双氧水,一方面丙酮酸通过降低组蛋白表达来阻滞细胞周期,进而抑制肿瘤细胞增殖;另一方面双氧水与CPPO反应释放化学能激发光敏剂Ce6,产生单线态氧杀伤肿瘤细胞。通过上述代谢调控和协同机制可以高效杀伤GBM细胞。
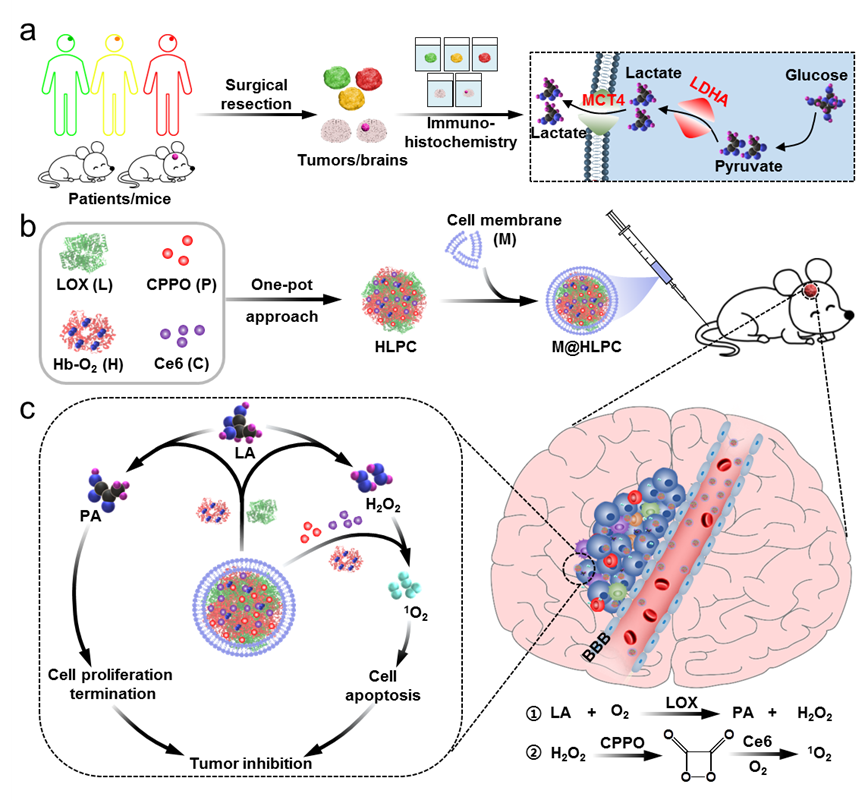
图1仿生剂型用于GBM代谢调控和靶向协同治疗示意图。(a)胶质瘤样本中乳酸代谢通路代表性指标分析示意图;(b)仿生剂型M@HLPC的构建示意图;(c)M@HLPC的抑瘤机制示意图
上述仿生剂型所装载的药物具有很好的灵活性,可以按需进行不同组合。GMB细胞膜可从患者术后的肿瘤组织获得,在GMB术后抗复发个体化治疗方面具有较好的应用前景。在本论文中,研究团队不仅利用细胞系模型进行体内外研究,还构建了临床患者来源的仿生剂型hM@HLPC,并基于患者来源的肿瘤细胞和肿瘤异种移植模型进行机制和疗效的确认,进一步显示出了剂型工程和临床医学的交叉特色。
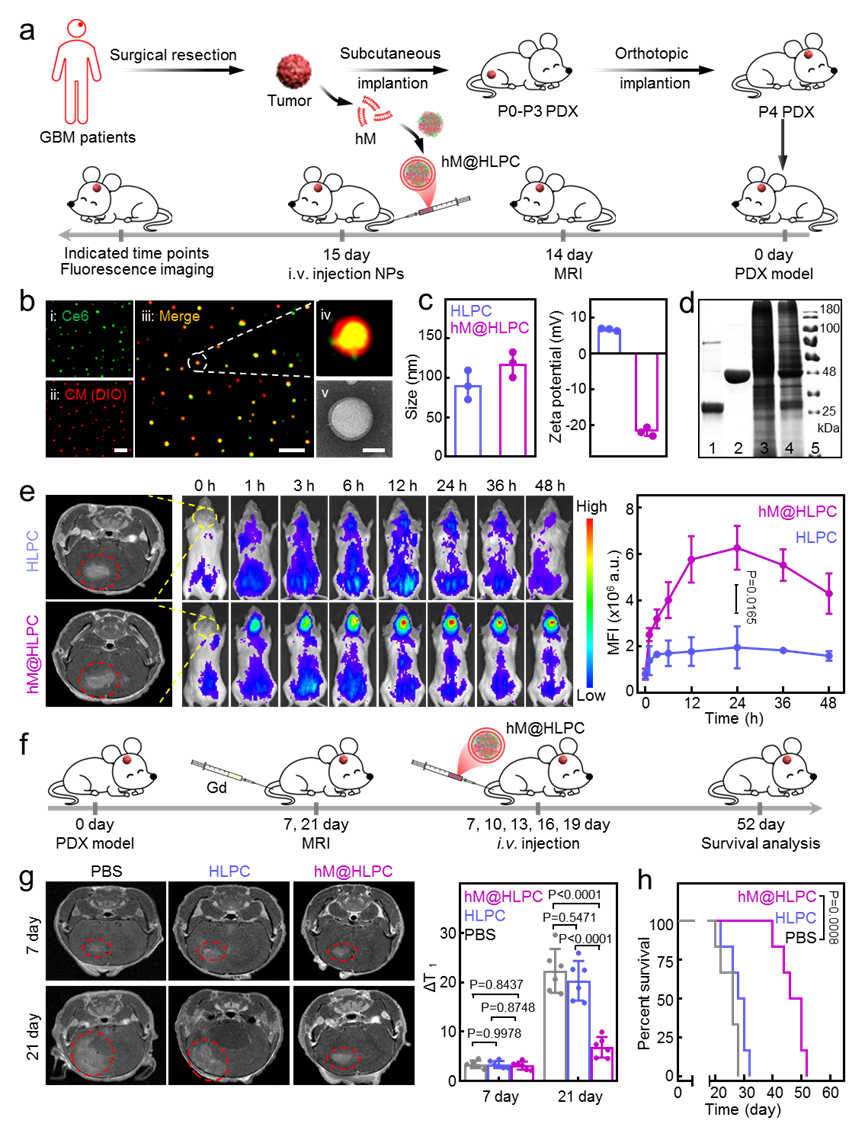
图2 个体化仿生剂型hM@HLPC在患者来源的异种移植瘤模型上的疗效评价。(a)模型的构建及靶向效果评估策略;(b-d)hM@HLPC的共聚焦和透射电镜成像、粒径电势及蛋白凝胶电泳;(e)小动物成像表征hM@HLPC在GBM部位的富集;(f)hM@HLPC在异种移植瘤模型上的治疗效果评估策略;(g, h)生长曲线及生存期曲线
十余年来,过程工程所生化工程国家重点实验室马光辉院士和魏炜研究员发现和创制了一系列药物和疫苗递送新剂型,在动物模型上成功用于肿瘤、传染病、炎症性疾病的防治,并且部分剂型已通过医院伦理批准进入个体化临床前和临床研究。相关工作相继发表于Nat Mater 2018, 17, 187、Nat Nanotechnol, 2021, 16,1413、Sci Transl Med, 2021, 13, eabb6981、Nat Biomed Eng 2021, 5, 414、Nat Biomed Eng 2021, 5, 968、Sci Adv 2021, 7, eabd7614、Sci Adv 2021, 7, eaba2458、Sci Adv 2020, 6, eaay7735、Sci Adv 2019, 5, eaaw3192、Nat Commun 2017, 8, 14537、Nat Commun 2019, 10, 5165等期刊上。
博士后卢贵红为该论文第一作者,过程所魏炜研究员、马光辉院士及深圳市第二人民医院李维平教授和谭回教授为共同通讯作者。该工作得到了国家自然科学基金项目、博士后面上项目、博士后站前项目、广东省自然科学基金、广东省区域联合基金等项目的支持。
附件下载: