光动力疗法(PDT)由于其优良的时空选择性和无创性,已经成为临床肿瘤治疗的有效手段之一。光敏剂(PS)作为PDT的核心要素,能够在激光的辅助下诱导产生活性氧物种(ROS)来介导肿瘤细胞的凋亡与坏死,但其高度共轭的分子结构同时也会带来水溶性差、光损伤效率低等现实问题。基于脂质体、聚合物等发展的药物载体在一定程度上改善了PS的生物利用度,然而其仍然面临着药物负载率不足和控释不易调控等挑战。蛋白质共组装涉及多种非共价相互作用,包括疏水效应、π-π堆叠、氢键及静电作用等。因此,基于蛋白质共组装的纳米药有望提高PS药物的负载率、递送稳定性与肿瘤选择性。
受自然界中金属蛋白酶的启发,中科院过程所闫学海研究员、邢蕊蕊副研究员与东京农工大学Ogino教授利用蛋白质与金属离子间的共组装配位作用,构建了卵清蛋白(OVA)、脱镁叶绿酸a(PheoA)和Zn2+多组分组装的纳米药,其具有纳米棒的结构,在水溶液及生理条件下表现出强稳定性,并且能够在肿瘤细胞的低pH环境中实现可控分解,高效释放药效组分。另外,实验结果表明该纳米药没有可探测的暗毒性,展示了其高的生物安全性。
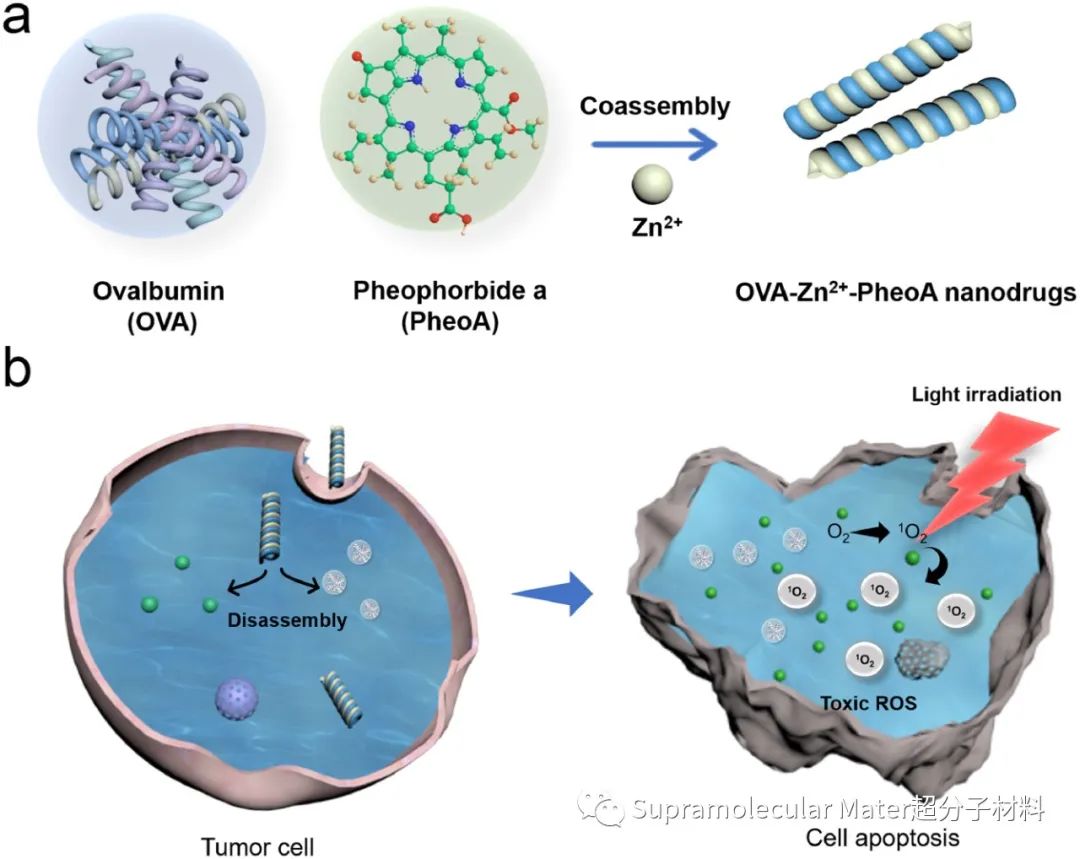
Fig. 1. PDT超分子纳米药构筑及体外杀伤肿瘤细胞机制示意图
OVA-Zn2+-PheoA纳米药能够简单地通过混合Zn2+、OVA和PheoA的水溶液获得。TEM图像显示所获得的纳米药是具有螺旋特征的纳米棒,其中OVA和Zn2+同时整合了配位与非共价相互作用来调节PheoA分子的堆积,抑制了PheoA分子间的大团簇聚集。傅里叶红外光谱(FTIR)和圆二色谱(CD)表征进一步证实了组装纳米棒的多组分配位及其螺旋二级结构的特征。UV-Vis吸收光谱表明PheoA的负载效率高于94%,同时OVA、Zn2+与PheoA的配位复合完全淬灭了单体PS的荧光,这有助于阻止血液中非沉默PS引起的光敏反应。进一步,研究人员探究了组装纳米棒对于环境pH变化的响应性,通过0.5%(v/v)的吐温80对PBS(pH 5.5和7.4)溶液的透析实验测试,表明纳米棒在模拟肿瘤细胞pH条件下,PS释放率在24 h达到约73%,具有低pH环境下可控分解的能力,这可能与PheoA羧基的质子化导致其与Zn2+的静电作用和配位作用减弱有关。
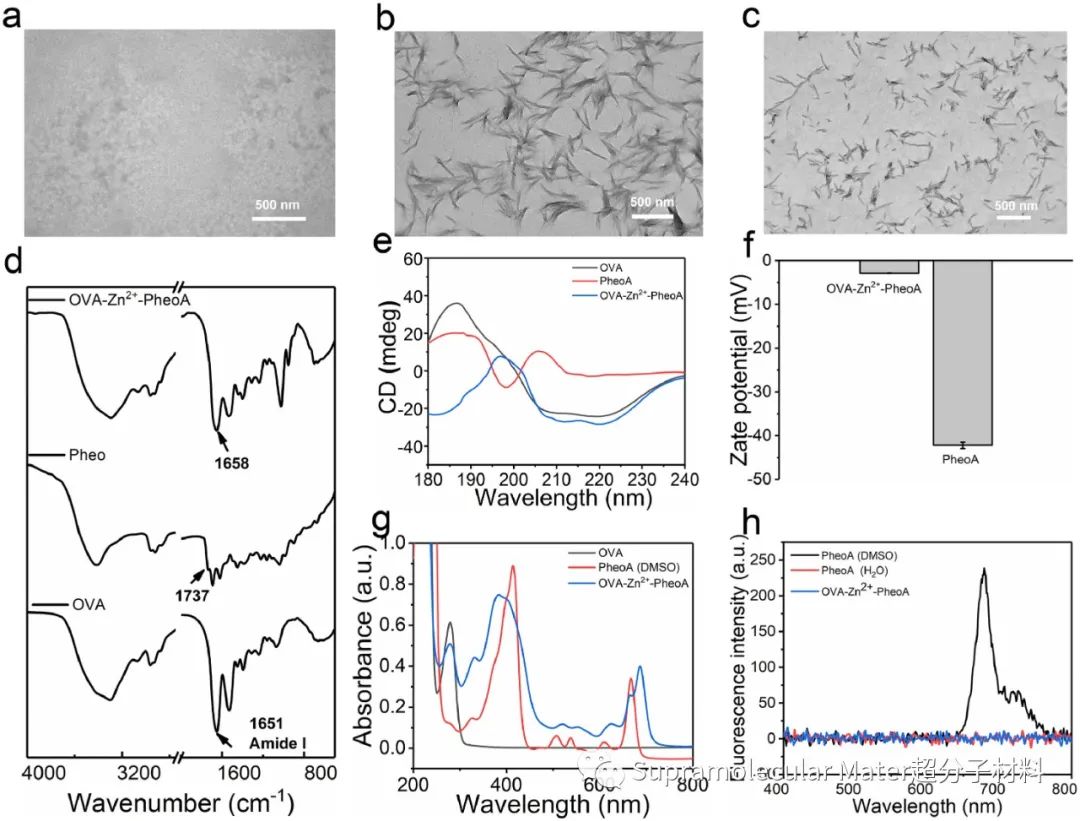
Fig. 2. OVA-Zn2+-PheoA纳米棒的表征. (a-c) TEM图像;(d) FTIR光谱;(e) CD光谱;(f) Zeta电位;(g) UV-Vis吸收光谱;(h) 荧光发射光谱
细胞抗增殖实验进一步证实了OVA-Zn2+-PheoA纳米棒良好的生物相容性、细胞内摄取以及ROS生成能力,因此能够有效地诱导B16细胞凋亡,增强体外抗肿瘤PDT效应。荷瘤小鼠体内注射分布结果也表明纳米棒会随着血液循环在肿瘤部位逐渐累积并释放出光敏药物PheoA,为进一步的体内诊断和治疗提供了支持。

Fig. 3. 不同时间注射OVA-Zn2+-PheoA纳米棒的小鼠荧光图像,虚线表示肿瘤区域
相关研究论文以题为Multicomponent coassembled nanodrugs based on ovalbumin, pheophorbide a and Zn2+ for in vitro photodynamic therapy发表在科爱旗下超分子材料领域国际高水平期刊《Supramolecular Materials》上。通讯作者是中科院过程所的闫学海研究员、邢蕊蕊副研究员以及东京农工大学的Kenji Ogino教授。
参考文献:
Multicomponent coassembled nanodrugs based on ovalbumin, pheophorbide a and Zn2+ for in vitro photodynamic therapy.
Xiaoyan Ma, Yamei Liu, Shukun Li, Kenji Ogino, Ruirui Xing, Xuehai Yan
Supramol. Mater., 2022, 1, 100010.
https://www.sciencedirect.com/science/article/pii/S2667240522000046
附件下载: